简介:UCLA的Nasim Annabi团队将重组人滋养蛋白作为一种高生物相容性和弹性的生物墨水用于复杂软组织的3D打印。对带血管蒂的心脏结构进行了生物打印,并对其功能进行了体外和体内的评估,结果显示了弹性生物墨水打印3D功能心脏组织的潜力,研究以“Human‐Recombinant‐Elastin‐Based Bioinks for 3D Bioprinting of Vascularized Soft Tissues”为题发表于Advanced Materials。
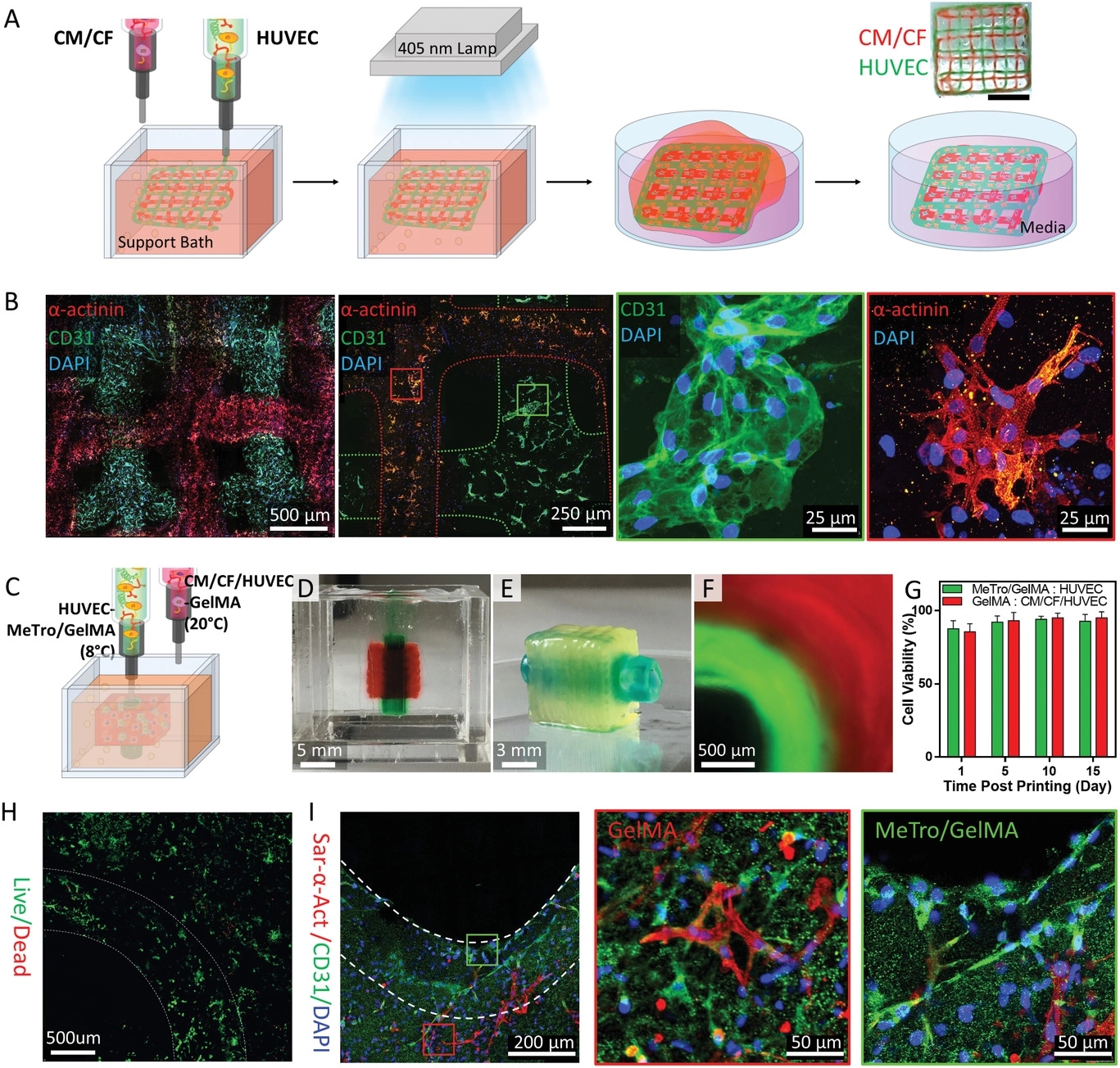
原文链接:https://doi.org/10.1002/adma.202003915
简介:中国科学院深圳先进技术研究院医药所人体组织与器官退行性研究中心阮长顺研究员团队、潘浩波研究员团队与天津大学材料学院刘文广教授团队合作,基于纳米粘土(Nanoclay)/ N-丙烯酰甘氨酸酰胺(NAGA)/明胶甲基丙烯酰(GelMA)成功构筑了一种氢键增强的高强度纳米复合医用水凝胶墨水(简称CNG 打印墨水),结合3D同轴打印技术成功构建具有高韧性、超拉伸性、抗压性、快速自恢复性能的小口径微管,且具有规模化生产潜能。此外,该微管还展示出良好的生物学特性,可促进内皮细胞的粘附、铺展和内皮化,为3D打印小口径微管支架应用于组织再生奠下基础。该研究为扩大高强度微管的规模化制造开辟了一种通用且简便的方法,该技术在管状组织的再生中具有巨大的潜力。相关研究成果以“Coaxial Scale-up Printing of Diameter-tunable Biohybrid Hydrogel Microtubes with High Strength, Perfusability and Endothelialization”为题发表在权威刊物Advanced Functional Materials。
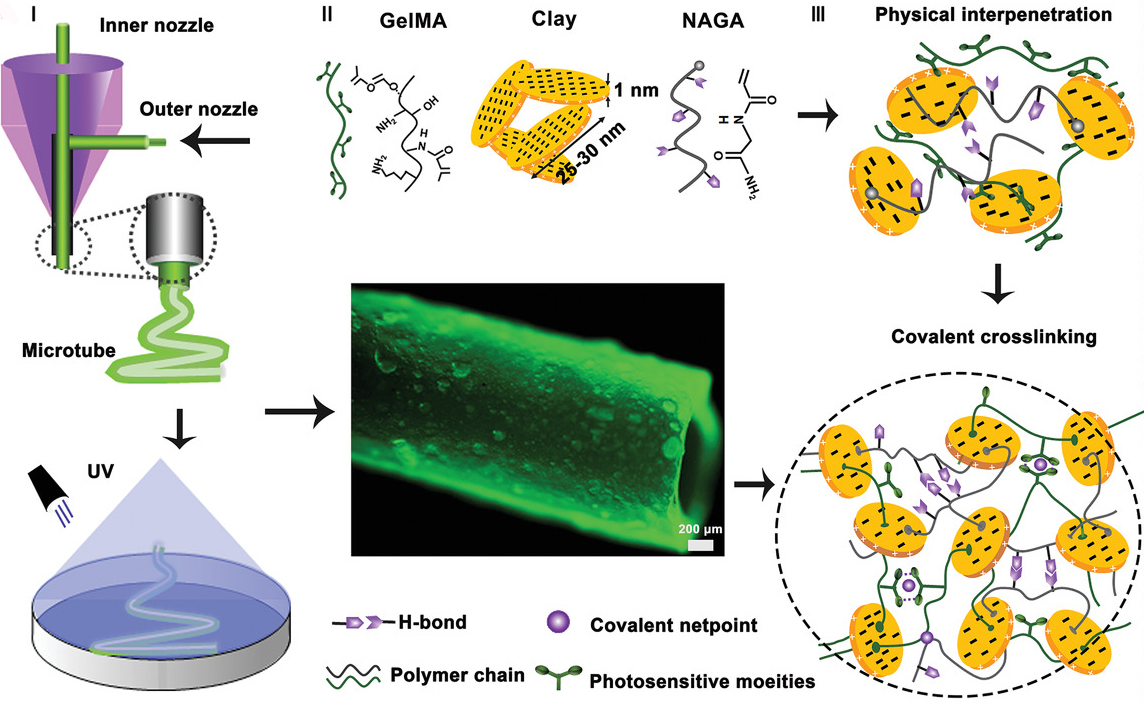
原文链接:https://doi.org/10.1002/adfm.202001485
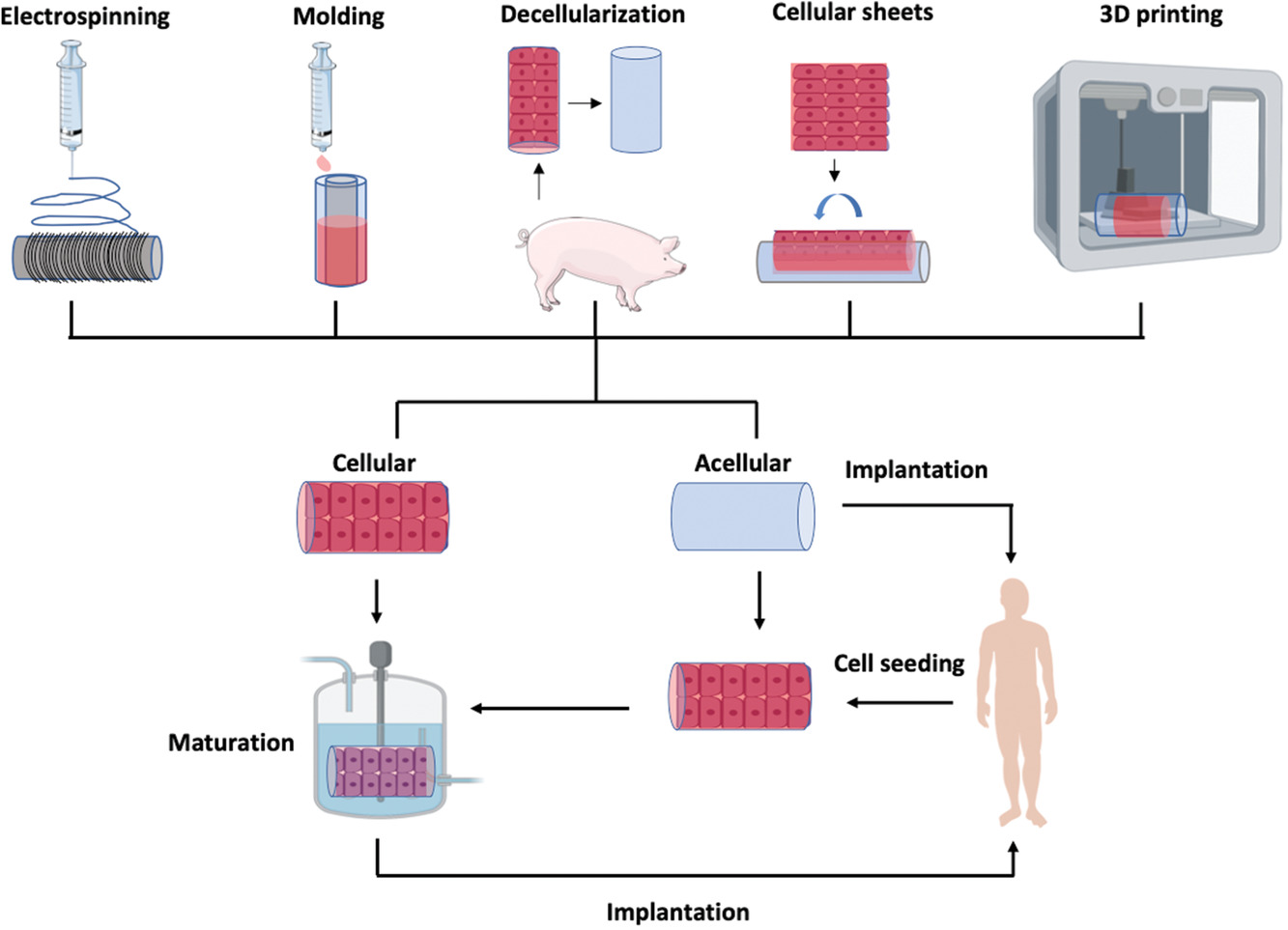
简介:哈尔滨工业大学的刘海涛副教授团队从5个方面对3D打印技术进行血管再生进行了阐述:1)面向血管再生的组织工程支架的意义和重要性;2)血管支架的三维建模方法;3)血管支架中常用的3D打印材料;4)血管支架制造中常见的3D打印技术;5)血管支架的临床转化。此外,鉴于传统制造技术的优势,论文还讨论了血管支架制备中常涉及的其它技术,包括铸造、静电纺丝及乐高积木式构建。相关论文“3D printing of tissue engineering scaffolds: a focus on vascular regeneration”表在Bio-Design and Manufacturing杂志上。
原文链接:https://doi.org/10.1007/s42242-020-00109-0
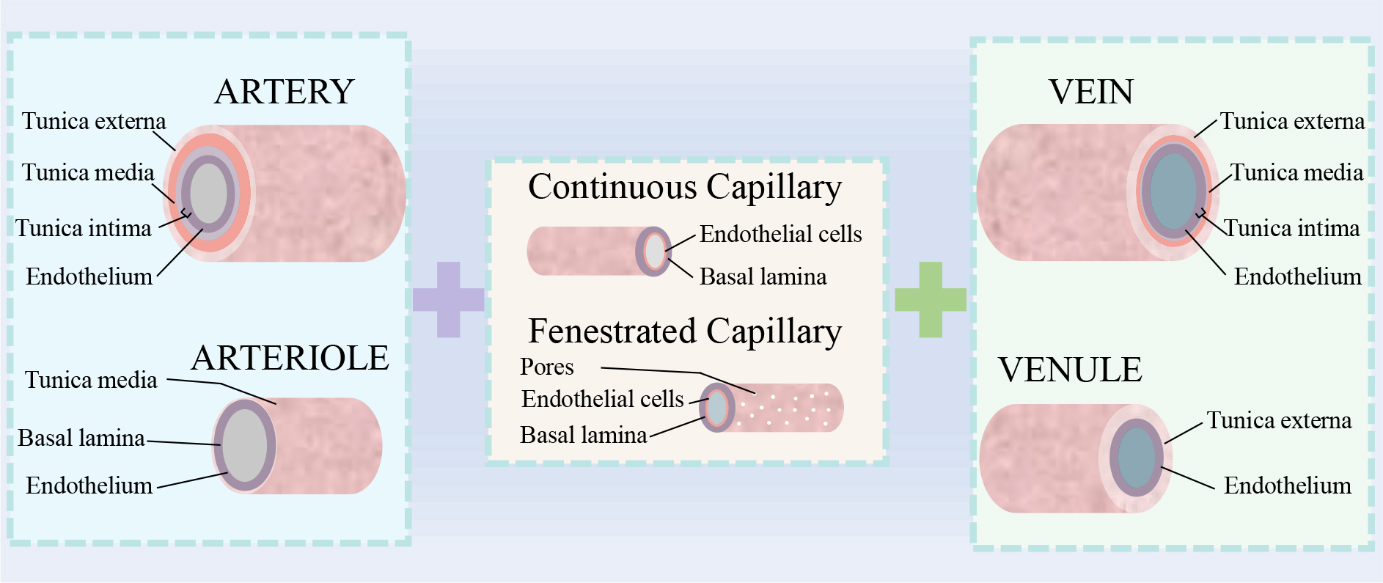
简介:哥伦比亚大学Gordana Vunjak-Novakovic教授团队讨论了工程化毫米级,宏观,以及微观血管的设计考虑因素及技术,进一步提供了用于工程化多尺度血管系统的最新技术的示例,最终确定了限制血管化组织临床转化的关键挑战,并提出了关于未来探索方向的展望。该综述简要总结了血管树的结构,其在胚胎发生过程中的形成以及体内的基本功能。其次探索制造血管系统不同层次的方法,从用于移植的大小口径的血管,到器官芯片平台和工程化组织的宏微尺度流道。进一步讨论了制造多尺度血管系统的最新技术。在整个过程中,将涵盖到影响这些子领域发展的大量开创性论文,并强调了过去几年在推动该领域向前发展方面的主要进展。最后概述了我们对当前该领域面临的挑战,以及对未来研究以及有望推动工程化组织转化的制造策略的看法。相关论文“From Arteries to Capillaries: Approaches to Engineering Human Vasculature”表在Advanced Functional Materials杂志上。
原文链接:https://doi.org/10.1002/adfm.201910811
简介:伦敦帝国理工学院生物医学工程研究所Molly M.Stevens团队以温敏的明胶基生物墨水作为可打印的牺牲模板,以可光交联的GelMA作为填充细胞外基质模板。37℃下,明胶自发溶解形成贯穿的血管网络框架。该研究通过无孔隙3D打印方法实现了个性化、均一管状结构三维凝胶网络的构建。相比其他牺牲墨水式3D打印方式,该方法解决了三维凝胶网络易坍塌、低粘度生物墨水难以成型、内皮细胞种植效率低等难题,且可以用来构建内部互通良好的水凝胶基微流控芯片。相关论文“Void-Free 3D Bioprintingfor In Situ Endothelialization and Microfluidic Perfusion”表在Advanced Functional Materials杂志上。
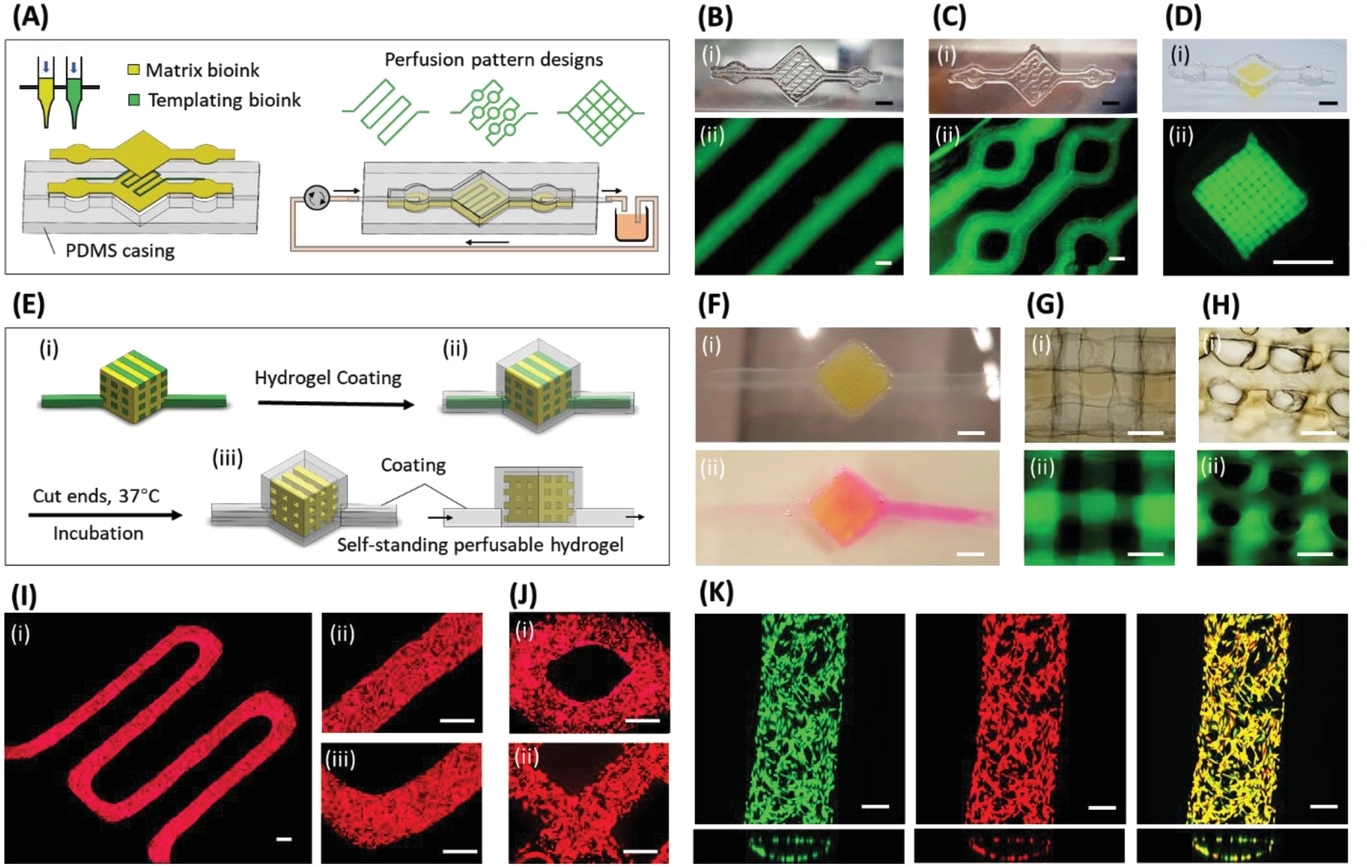
原文链接:https://doi.org/10.1002/adfm.201908349
简介:浙江大学贺永教授团队通过耦合牺牲打印和同轴打印工艺,提出组织/血管同轴3D打印思路,以实现血管+结构同步制造。通过设计核/壳型的GelMA/明胶墨水,利用同轴喷头将载组织细胞墨水(外喷头)和载内皮细胞牺牲墨水(内喷头)同时挤出,打印时牺牲墨水支撑流道,培养时牺牲墨水融化形成通畅的流道网络,同时内皮细胞从牺牲墨水中释放,粘附于流道内壁进行血管化,实现从流道网络到血管化网络的转变。基于此方法,实现了血管化大块组织结构(≥1 cm)的打印及体外长时间培养(≥20 days),并成功将其应用于血管化的肿瘤模型和骨组织的制造。相关论文“Directly Coaxial 3DBioprinting of Large-scale Vascularized Tissue Constructs”近日刊登在Biofabrication杂志上。
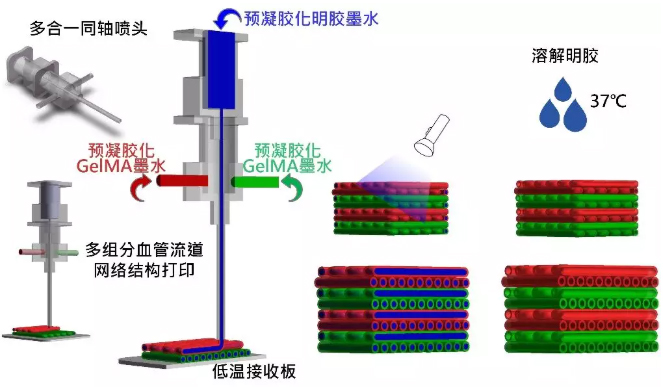
原文链接:https://doi.org/10.1088/1758-5090/ab7e76
简介:韩国理工大学的SongwanJin团队将一种预设的挤出生物打印技术用于创建肝小叶阵列,该技术可以同时创建异质的、多细胞和多材料的结构。制造的肝小叶包括肝细胞、内皮细胞和管腔。内皮细胞包围肝细胞、小叶外部、管腔,最后相互连接形成高度血管化结构。该研究利用挤出式生物3D打印技术打印出的肝小叶结构至直径为1mm,其中心处的空腔直径为150um,且生物墨水中高密度的细胞通过相邻细胞和细胞ECM相互作用加速细胞形成组织,可以保持结构完整性和细胞功能,从而将复杂的不均匀的肝小叶结构打印成一系列的肝小叶结构阵列,从而实现从微观到宏观组织的生物打印。相关论文“Bioprinting of Multiscaled Hepatic Lobules within a Highly Vascularized Construct”发表在Small杂志上。
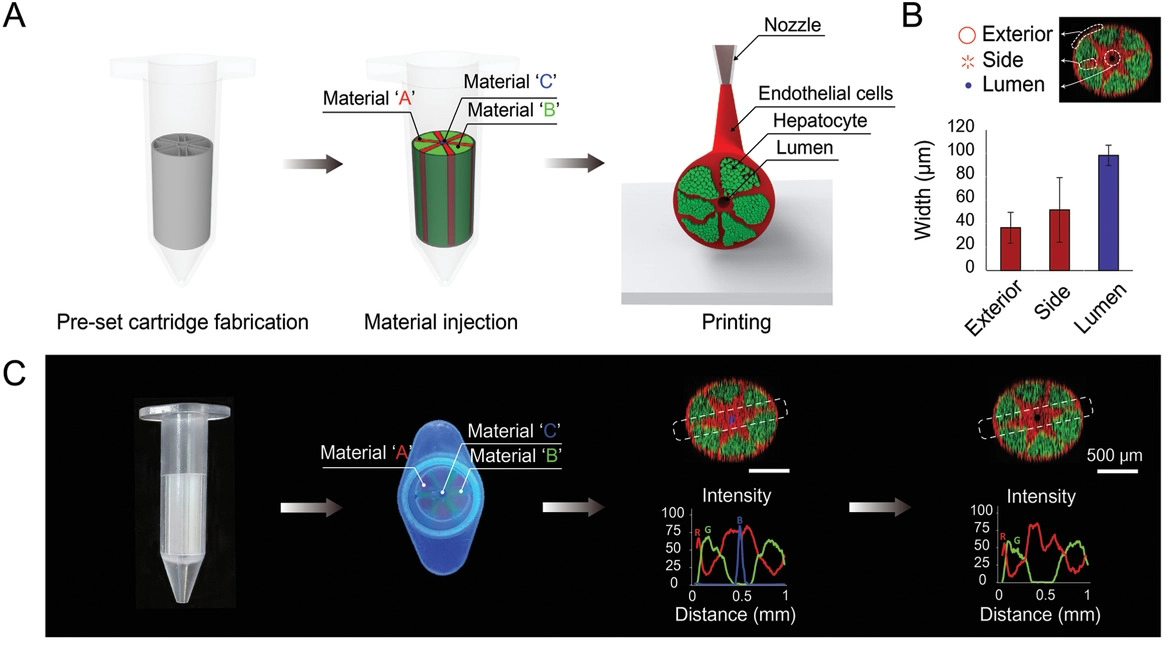
原文链接:https://doi.org/10.1002/smll.201905505
简介:美国加州大学的Ali Khademhosseini教授与Junmin Lee教授团队联合提出构建三维皮肤组织模型的思路:(1)在具有0.4μm孔径的聚酯多孔膜上打印载有HUVECs的GelMA/海藻酸盐水凝胶,该结构有利于真皮成纤维细胞与内皮细胞的相互作用以及促进营养物的扩散(形成内部血管网络);(2)打印封装有人真皮成纤维细胞的GelMA水凝胶,通过调节基质硬度影响细胞的生长和功能;(3)通过多次在真皮层上方铺覆包裹有角质细胞的明胶形成多层的表皮明胶涂层。该研究提供了一种简单的方法,利用生物医学方法和生物工程技术来优化皮肤组织的每一层。构建出的3D皮肤组织作为一个多功能平台,使体外皮肤模型的重建成为可能。相关论文“Biofabrication of endothelial cell, dermal fibroblast, and multilayered keratinocyte layers forskin tissue engineering”发表在Biofabrication杂志上。
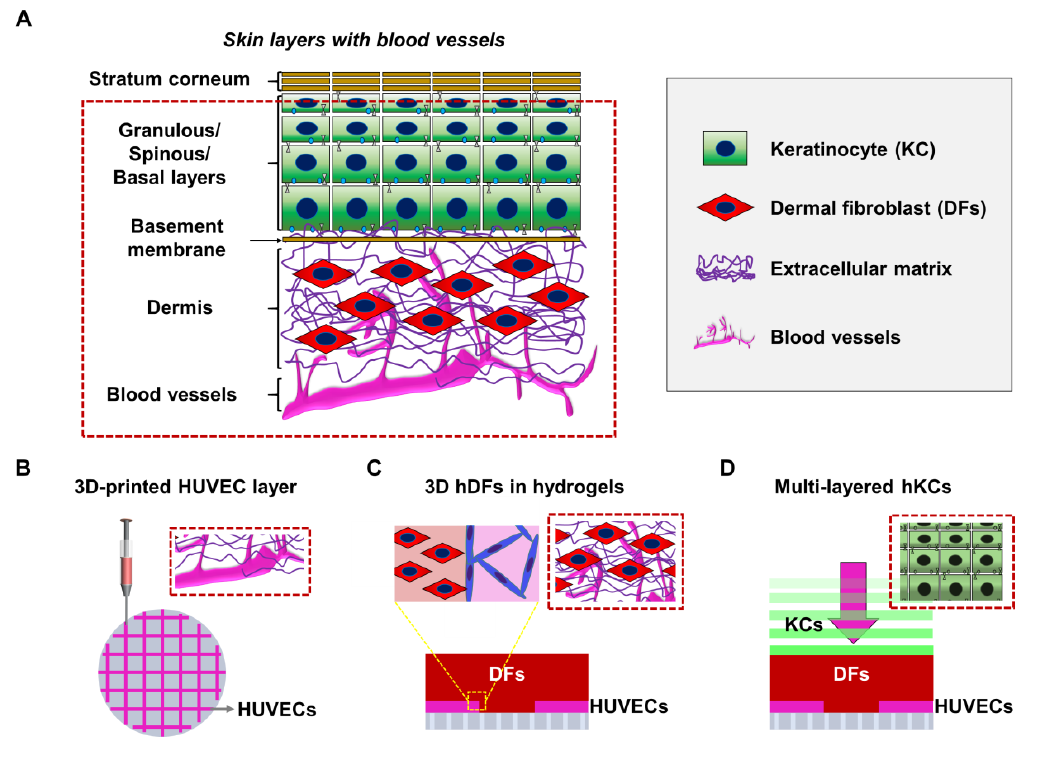
原文链接:https://doi.org/10.1088/1758-5090/aba503
简介:浙江大学贺永教授团队提出了一种在水凝胶材料上制造多级血管网络的新方法:通过EFL团队研发的高精度3D打印机打印多级的流道网络模板,利用二次交联原理实现水凝胶流道的封装。该研究成功的在体外重建的完整的血供网络(动脉-毛细血管-静脉),以及高度分叉网络,螺旋血管,血管狭窄等。建立了具有功能性血管网络的大块乳腺肿瘤组织。借助于此结合多尺度三维打印以及二次交联的工艺,科研人员将能够构建一系列体外模型用于生物医学研究,如肿瘤发展过程的研究,肿瘤和血管相互作用的探索,以及抗肿瘤药物的筛选等。相关论文“Construction ofmulti-scale vascular chips and modelling of the interaction between tumours andblood vessels”已在RSC杂志社的旗舰期刊Materials Horizons上发表。
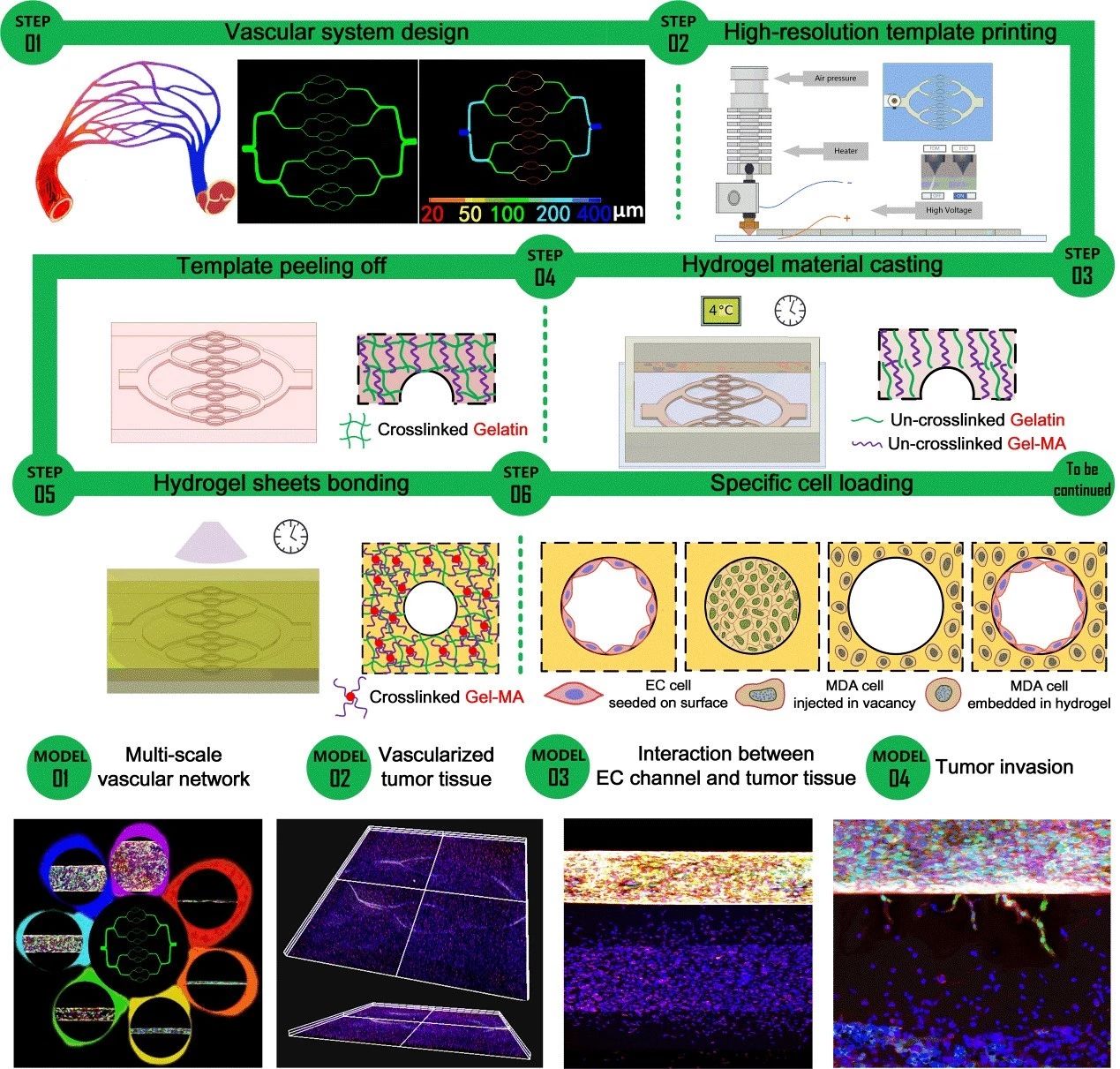
原文链接:https://doi.org/10.1039/C9MH01283D
简介:哈佛大学Yu Shrike Zhang教授团队设计构建出一种同时拥有血管和淋巴管的肿瘤芯片平台,嵌入在一个由微流动系统控制的微流控生物反应器内,并实现了GelMA水凝胶基质内MCF-7乳腺癌细胞3D培养的动态微环境。为了匹配体内对应特性,其中的中空血管和淋巴管分别利用两种不同组分的生物墨水进行打印,可以通过生物墨水组分的优化来单独调控包埋在水凝胶肿瘤基质中的血管和淋巴管的渗透性能。不同的血管/淋巴管组合以及癌细胞的分布对生物分子和抗癌药物展现出完全不同扩散曲线。这一体外模型将用于研究在抗肿瘤药物筛选的过程中肿瘤微环境内血管和淋巴管的动力学和相互作用,它提出将有望提高药物筛选的准确性。相关论文“A Tumor-on-a-Chip System with Bioprinted Blood and Lymphatic Vessel Pair”刊登在WILEY旗下的Advanced Functional Materials杂志上。
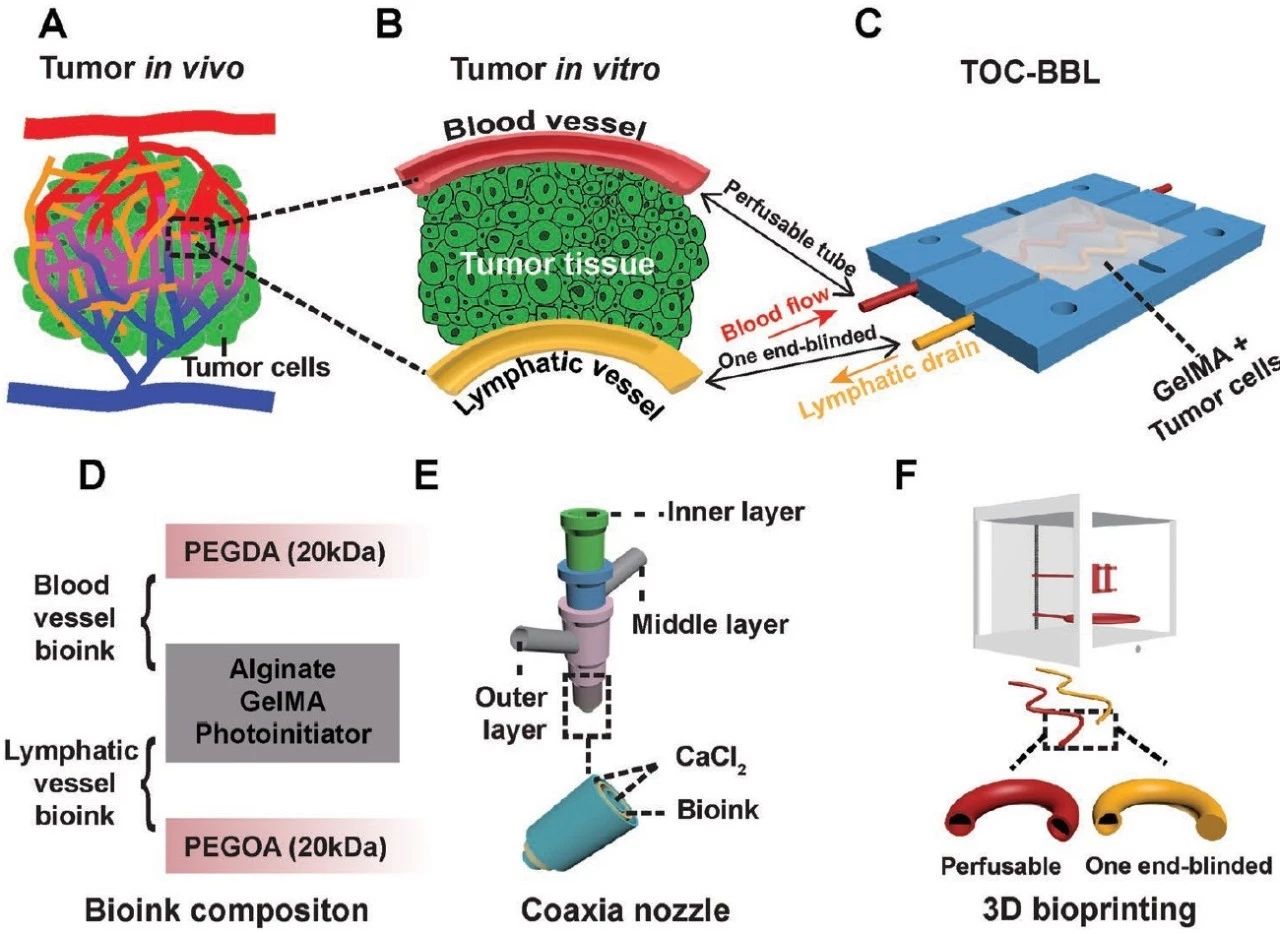
原文链接:https://doi.org/10.1002/adfm.201807173
简介:哈佛大学Wyss研究所Jennifer A. Lewis等研究人员开发了一项名为 Sacrificial WritingInto Functional Tissue ( SWIFT ) 的技术。在该研究中,首先用微孔阵列制造数十万个OBBs(Organ building blocks,器官构建块,由患者特异性诱导多功能干细胞组成的致密细胞类器官)。然后将器官构建块(0BBs)与I型胶原和基质凝胶组成的ECM溶液在0-4℃下混合成高细胞密度的活体基质,最后通过嵌入的牺牲3D生物打印引入可灌注的血管通道。实验结果表明,SWIFT生物打印方法可以快速组装可灌注的患者器官特异性组织。相关论文"Biomanufacturing of organ-specific tissues with high cellulardensity and embedded vascular channels"发表在Science Advances杂志上。
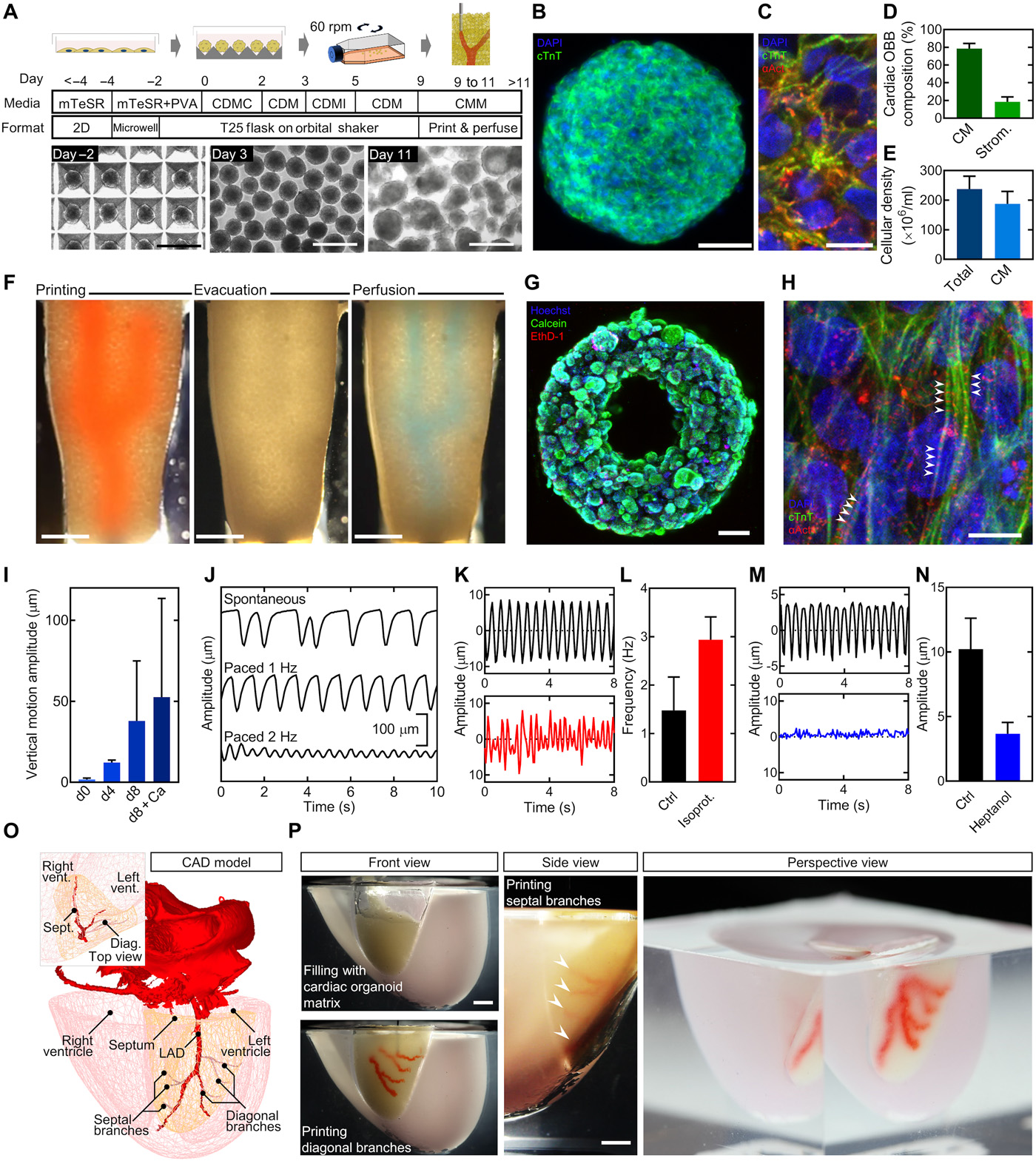
原文链接:https://doi.org/10.1126/sciadv.aaw2459
简介:乌得勒支大学的DebbyGawlitta和维尔茨堡大学的JürgenGroll开发了一种由溶液电纺丝与熔融近场电直写相结合的混合制造方法,并用其制备了一种能模拟组织结构的双层复合血管支架,其中包括内层随机定向的致密纤维网和外层定向可控的纤维。该支架能够诱导细胞形成连续的管腔单层内皮细胞和定向的平滑肌细胞层,从而促进组织细胞特异性分化。并且该方法不需要额外的可溶性因子或支架表面的生物活化材料,说明异型支架的结构设计可以诱导细胞的生长和分化。这种复合结构的异质支架具有类似于原生血管内外膜结构,内侧溶液纺丝层具有小直径与低细胞通透性,能促进内皮细胞层的形成,其未来还可以利用异型设计来实现免疫反应的调节,使之朝着再生的方向发展。相关论文"Heterotypic Scaffold Design Orchestrates Primary Cell Organization and Phenotypes inCocultured Small Diameter Vascular Grafts"发表在Advanced Functional Materials杂志上。
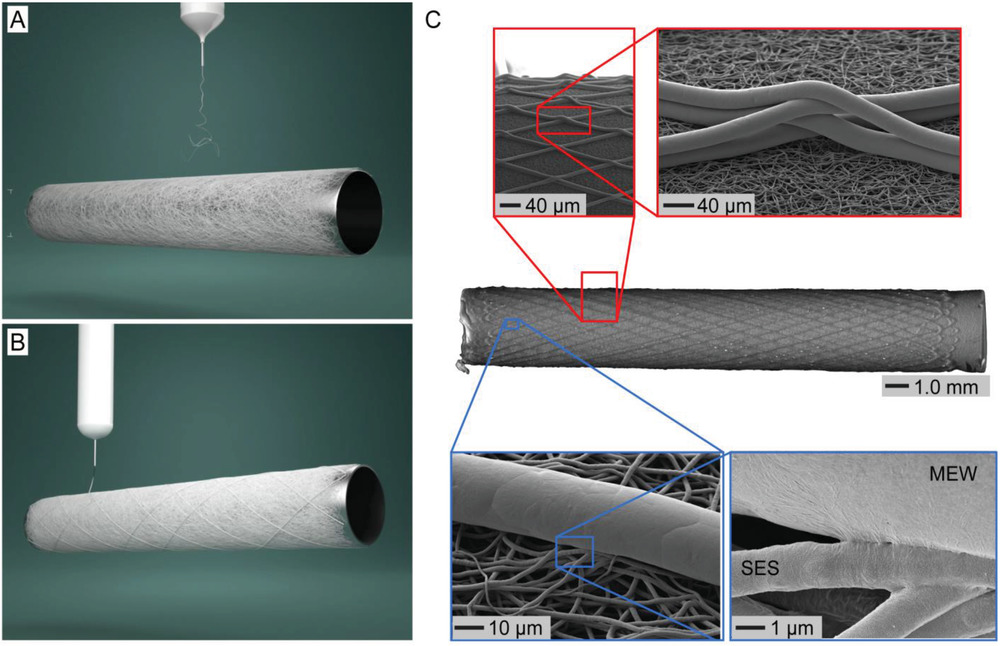
原文链接:https://doi.org/10.1002/adfm.201905987
简介:浙江大学贺永教授团队结合这几年围绕同轴生物3D打印所做的一些工作,梳理和总结了该技术的最新研究进展,撰写了相关综述。综述详述了同轴生物3D打印的基本原理,技术特点以及使用该技术构造内含营养网络,特别是血管化的大尺寸结构的最新尝试,该技术为快速制造血管化的组织/器官原型提供了可能。论文“Coaxial 3D bioprinting of organ prototyping, from nutrients delivery to vascularization”发表在Journal of Zhejiang University-SCIENCE A 杂志上。
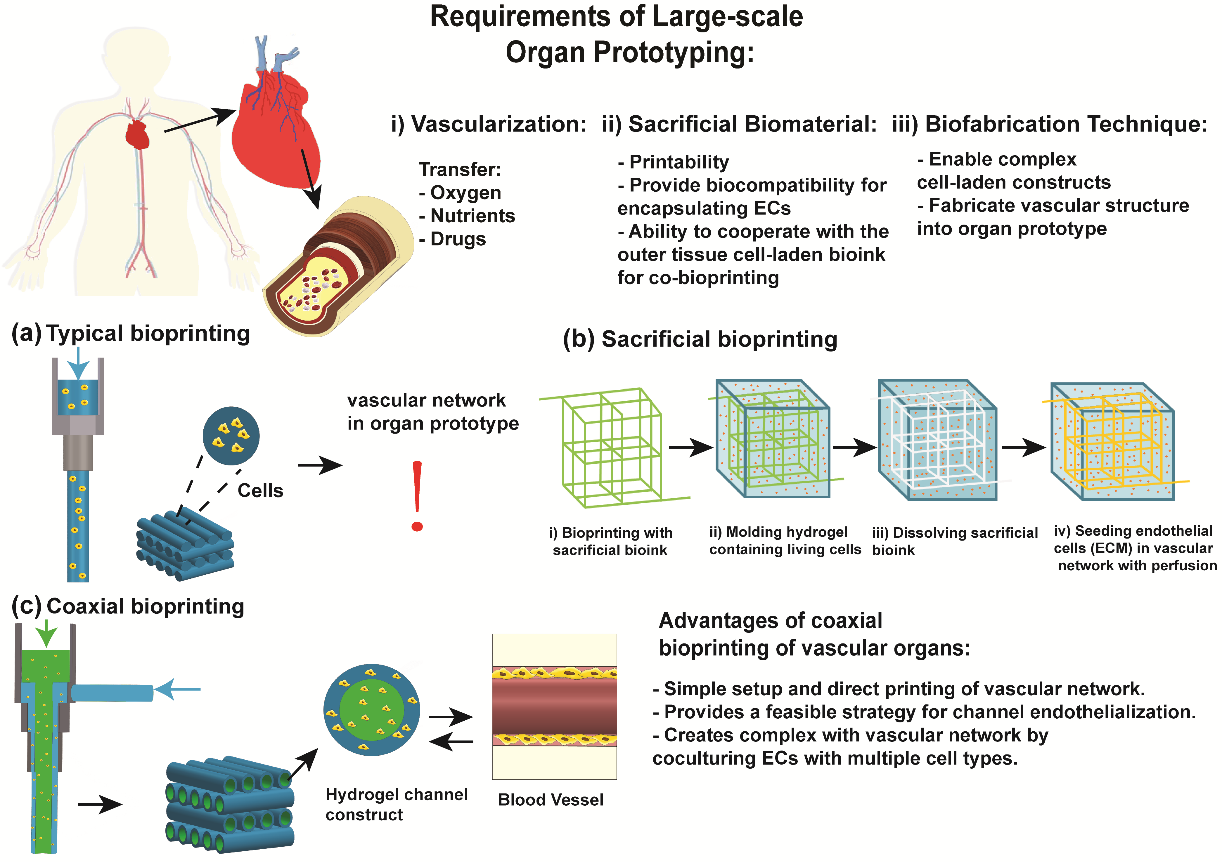
原文链接:https://doi.org/10.1631/jzus.A2000261
Copyright ©2022 Copyright: EFL-Tech Co.,Ltd, Suzhou, China 苏ICP备19070244号-1
Technical support: Wanhe Technology